Hace poco, dando una clase particular de tercero de ESO, me encontré con que en formulación química les decían que existían los «haluros de oxígeno», más allá del Fluoruro de Oxígeno, que, debido a la mayor electronegatividad del Fluor ante el Oxígeno, era el único compuesto binario que el oxígeno podía formar en el que no fuese el elemento más oxidante de la naturaleza.
Pero parece ser (cosa que no conocía) que la IUPAC a partir del 2005 dictaminó en su sapiencia infinita, que la naturaleza oxidante del oxígeno pesaba menos a la hora de nombrar los compuestos con los demás halógenos que el mero hecho de estar posicionado en una tabla periódica a la derecha de los mismos y por tanto hacer «difícil de entender» que pueda ser más electronegativo que los halógenos allende el Fluor (cualidad medible, por otro lado, de manera cuantificable al menos dentro de un convenio que tiene factores cuantificables y no posicionales como la energía de ionización o la afinidad electrónica).
La electronegatividad no se puede medir experimentalmente de manera directa como, por ejemplo, la energía de ionización, pero se puede determinar de manera indirecta efectuando cálculos a partir de otras propiedades atómicas o moleculares.
Se han propuesto distintos métodos para su determinación y aunque hay pequeñas diferencias entre los resultados obtenidos todos los métodos muestran la misma tendencia periódica entre los elementos.
El procedimiento de cálculo más común es el inicialmente propuesto por Pauling. El resultado obtenido mediante este procedimiento es un número adimensional que se incluye dentro de la escala de Pauling. Esta escala varía entre 0,65 para el elemento menos electronegativo (francio) y 4,0 para el mayor (flúor).
Con esta definición que dio lugar a la Esala de Pauling, obtenemos una electronegatividad de 3,5 para el Oxígeno, frete a 3,0, 2,8 y 2,5 para el Cloro, Bromo y Yodo respectivamente.
I2O7 vs O7I2
Así que engendros como esta combinación de Oxígeno y Yodo han de nombrarse como DiYoduro de HeptaOxígeno, cuando se ha nombrado hasta «ahora» (olvidada parece ya la tradicional y antiquísima anhídrida) como un mucho más racional, según Stock, Óxido de Yodo (VII) o la nomenclatura sistemática que no acaba de imponerse: Dióxido de heptayodo. Racional en el sentido de que se sitúa a la izquierda de la fórmula el elemento más electropositivo y a la derecha el más electronegativo, atendiendo a criterios empíricos, medibles, pero parece ser que no es así ahora, sino que pesa más la mera ubicación de los elementos en una tabla, sin atender a medidas, lo que pasa a ser más irracional y, desde luego, menos empíricamente justificado.
Para justificarlo, han alterado el sentido de lo que se conoce como electronegatividad, creando una ficticia tabla que no corresponde con los valores cuantificables, pero que hace más «fácil» su lectura:
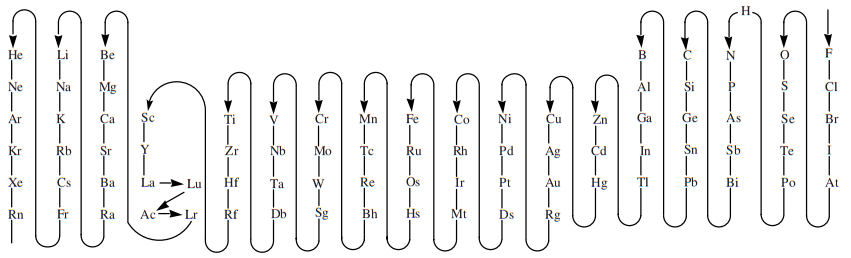
Es absurdo olvidar la medida o el criterio cuantificable y atender a la posición que algo ocupa en un «nomenklator». Es como ignorar que la naturaleza es la que es y querer «domarla» en lugar de «domesticarla» o comprenderla.
Me parece un verdadero disparate este cambio que sugiere la IUPAC y que ha despertado más de una opinión en contra.
El problema, entre otros, es que el número de oxidación del Oxígeno en las combinaciones con todos los elementos menos electronegativos (entre los que están los halógenos indicados, salvo, como dijimos, el Fluor), sigue siendo como no podía ser de otra manera, -2, lo que hace que el elemento oxidante siga siendo el oxígeno (ya le tocará alguna vez entender eso de las reacciones REDOX), así que técnicamente está «oxidando» a los halógenos (con sus correspondiente estados de oxidación positivos) y, por tanto ¡¡¡¡siendo Óxidos!!!!